Ligações Químicas
INTRODUÇÃO
 Você já verificou que alguns materiais são sólidos (o carvão); outros, líquidos (a água) e outros, gasosos (o ar); alguns são duros (granito) e outros moles (cera); alguns conduzem a corrente elétrica (metais), outros não (borracha); alguns quebram-se facilmente (vidro), outros não (aço), e assim por diante. Por que existe essa grande diferença de propriedades entre os materiais que conhecemos? Isso se deve, em grande parte, às ligações existentes entre os átomos (ligações químicas) e à arrumação espacial que daí decorre (estrutura geométrica do material). É o que vamos estudar neste capítulo e no seguinte.
Você já verificou que alguns materiais são sólidos (o carvão); outros, líquidos (a água) e outros, gasosos (o ar); alguns são duros (granito) e outros moles (cera); alguns conduzem a corrente elétrica (metais), outros não (borracha); alguns quebram-se facilmente (vidro), outros não (aço), e assim por diante. Por que existe essa grande diferença de propriedades entre os materiais que conhecemos? Isso se deve, em grande parte, às ligações existentes entre os átomos (ligações químicas) e à arrumação espacial que daí decorre (estrutura geométrica do material). É o que vamos estudar neste capítulo e no seguinte.
Hoje sabemos que, em condições ambientes, só os gases nobres são formados por átomos isolados uns dos outros, ou seja, átomos que têm pouca tendência de se unir com outros átomos; dizemos então que eles são muito estáveis (pouco reativos). Os átomos dos demais elementos químicos, ao contrário, atraem-se não só mutuamente como também átomos de outros elementos, formando agregados suficientemente estáveis, que constituem as substâncias compostas. Assim, por exemplo, não existem sódio (Na) nem cloro (Cl) livres na natureza; no entanto, existem quantidades enormes de sal comum (NaCl), em que o sódio e o cloro aparecem unidos entre si. As forças que mantêm os átomos unidos são fundamentalmente de natureza elétrica e são responsáveis por ligações químicas.
Na metade do século XX, os cientistas já haviam percebido que o átomo de hidrogênio nunca se liga a mais de um outro átomo. Já, por exemplo, o átomo de oxigênio pode ligar-se a dois átomos de hidrogênio, o de nitrogênio a três de hidrogênio, o de carbono a quatro de hidrogênio.
Na prática, quando dois átomos vão se unir, eles “trocam elétrons entre si” ou “usam elétrons em parceria”, procurando atingir a configuração eletrônica de um gás nobre. Surgem daí os três tipos comuns de ligação química — iônica, covalente e metálica.
LIGAÇÃO IÔNICA ou ELETROVALENTE
O átomo de sódio cede definitivamente 1 elétron ao átomo de cloro. Desse modo, forma-se um íon positivo (cátion Na+) e um íon negativo (ânion Cl-), ambos com o octeto completo, ou seja, com a configuração de um gás nobre (no caso, neônio e argônio, respectivamente).
Considerando que essa explicação envolve apenas os elétrons da última camada (elétrons de valência), é comum simplificar a representação anterior da seguinte maneira:
Outros exemplos:
 Como podemos observar, o número de íons que se unem é inversamente proporcional às suas respectivas cargas (valências). Disso resulta a seguinte regra geral de formulação:
Como podemos observar, o número de íons que se unem é inversamente proporcional às suas respectivas cargas (valências). Disso resulta a seguinte regra geral de formulação:A ligação iônica ocorre, em geral, entre átomos de metais com átomos de ametais, pois:
• os átomos dos metais possuem 1, 2 ou 3 elétrons na última camada e têm forte tendência a perdê-los (veja os casos do Na, do Mg e do Al, nos exemplos anteriores);
• os átomos dos ametais possuem 5, 6 ou 7 elétrons na última camada e têm acentuada tendência a receber mais 3, 2 ou 1 elétron e, assim, completar seus octetos eletrônicos (veja o caso do Cl, nos exemplos anteriores).
Essa idéia pode ser generalizada se olharmos para a Tabela Periódica. Como sabemos, nas colunas A, o número de elétrons na última camada de cada elemento coincide com o próprio número da coluna. Sendo assim, temos:
Os elementos da coluna 4A têm quatro elétrons na última camada. Eles não apresentam tendência nem para perder nem para ganhar elétrons. Por esse motivo, quando esses elementos se unem a outros para atingir um octeto completo, tendem a não formar ligações iônicas.
LIGAÇÃO COVALENTE ou MOLECULAR
Consideremos, como primeiro exemplo, a união entre dois átomos do elemento hidrogênio (H) para formar a molécula da substância simples hidrogênio (H2):
Funções Químicas
ÁCIDOS
Os
ácidos são muito comuns em nosso dia-a-dia: o vinagre contém ácido acético (C2H4O2);
o limão, a laranja e demais frutas cítricas contêm ácido cítrico (C6H8O7);
a bateria de um automóvel contém ácido sulfúrico (H2SO4);
o ácido muriático, usado para a limpeza de pisos, azulejos etc., contém ácido
clorídico (HCl); e assim por diante.
Os
ácidos são muito usados, nas indústrias químicas, para a produção de novos
materiais. Em particular, o ácido sulfúrico é o primeiro colocado em uso
industrial. Devemos lembrar, porém, que acidentes com trens e caminhões
transportando ácido sulfúrico podem dar origem a vazamentos do ácido, com
efeitos bastante danosos ao meio ambiente.
Fórmula Geral
A carga total positiva dos H+ deve anular a carga total
do radical negativo, de tal modo que a molécula seja eletricamente neutra. Desse
modo, representando o ânion (ou radical ácido) por A e supondo sua valência
igual a +x, chegamos à seguinte regra geral de formulação dos ácidos:
Nomenclatura dos ácidos
a) Hidrácidos - Não têm oxigênio na molécula
• O nome é feito com a terminação ídrico:
b) Oxiácidos - Têm oxigênio na molécula
• Quando o elemento forma apenas um oxiácido, usa-se a terminação ico:
Ácidos importantes
a) Ácido sulfúrico — H2SO4
O ácido sulfúrico é o produto químico mais utilizado na indústria;
por isso costuma-se dizer que o consumo de ácido sulfúrico mede o
desenvolvimento industrial de um país.
O H2SO4 puro é um líquido incolor, oleoso,
denso (d % 1,84 g/mL), corrosivo e extremamente solúvel em água (para
diluí-lo, deve-se despejá-lo lentamente em água, e nunca o contrário, pois,
devido ao calor liberado, quando se despeja água sobre H2SO4,
ela vaporiza rapidamente e pode se projetar contra as mãos ou o rosto do
operador). O H2SO4 ferve a 338 °C, que é um valor bem
acima da temperatura de ebulição dos ácidos comuns; por isso é considerado um ácido
fixo, isto é, pouco volátil.
b) Ácido clorídrico — HCl
O HCl puro, chamado de gás clorídrico ou cloridreto ou cloreto de
hidrogênio, é um gás incolor, não-inflamável, muito tóxico e corrosivo. Esse
gás é muito solúvel em água (cerca de 450 L de
gás clorídrico por litro de água, em condições ambientes). Sua
solução aquosa é denominada ácido clorídrico. Trata-se de uma solução incolor
que, quando concentrada, contém cerca de 38% de HCl em massa, é fumegante (pois
libera vapores de HCl), sufocante, muito tóxica e corrosiva.
O ácido clorídrico é usado na hidrólise de amidos e proteínas (indústria
de alimentos); na produção de corantes, tintas, couros etc. Na limpeza de pisos
e paredes de pedra ou de azulejo, usa-se o ácido muriático, que é o ácido
clorídrico impuro.
Além disso, é importante destacar que o ácido clorídrico é um dos
componentes do suco gástrico existente em nosso estômago. Sua ação é ajudar a
digestão dos alimentos.
c) Ácido nítrico — HNO3
O ácido nítrico é um líquido incolor, muito tóxico e corrosivo. Ferve
a 83 °C. É muito solúvel em água e, com o tempo e a influência da luz, sua
solução fica avermelhada devido à decomposição do HNO3 em NO2.
O ácido nítrico é usado na produção de compostos orgânicos
(explosivos, corantes, medicamentos etc.), na produção de fertilizantes agrícolas,
etc.
BASES OU HIDRÓXIDOS
As
bases são muito comuns em nosso cotidiano. Vários líquidos de limpeza usados
nas cozinhas contém bases, como o hidróxido de sódio (NaOH), presente em
substâncias para desentupir pias, o hidróxido de amônio (NH4OH),
encontrado no amoníaco etc. O chamado “leite de magnésia”, usado para combater
a acidez estomacal, contém hidróxido de magnésio (Mg (OH)2).
As
bases são também muito usadas nas indústrias químicas. O hidróxido de sódio,
por exemplo, é empregado na produção de sabões, detergentes, tecidos etc.
Fórmula Geral
A carga positiva do cátion é neutralizada pela carga negativa total das oxidrilas, originando a seguinte regra geral de formulação das bases:
Nomenclatura das bases
Bases importantes
a) Hidróxido de sódio — NaOH
O hidróxido de sódio, também chamado de soda cáustica, é um sólido
branco, de ponto de fusão 318 °C, muito tóxico e corrosivo e bastante solúvel
em água (dissolução muito exotérmica).
É uma das bases mais usadas pela indústria química, servindo na
preparação de compostos orgânicos (sabão, seda artificial, celofane etc.), na
purificação de óleos vegetais, na purificação de derivados do petróleo, na
fabricação de produtos para desentupir pias etc.
b) Hidróxido de cálcio —
Ca(OH)2
O hidróxido de cálcio é conhecido por cal hidratada, cal extinta ou
cal apagada. Esses nomes provêm de seu método de preparação, que é por
hidratação do óxido de cálcio (CaO), chamado de cal viva ou cal virgem:
O
Ca(OH)2 é um sólido branco pouco solúvel em água. A suspensão aquosa
de Ca(OH)2 é chamada de leite de cal ou água de cal. O maior uso do
hidróxido de cálcio é na construção civil:
•
na preparação de argamassa (massa para assentar tijolos);
•
na pintura de paredes (caiação).
É
usada também na agricultura, como inseticida e fungicida, e ainda no tratamento
(purificação) de águas e esgotos.
SAIS
Os sais são também muito comuns em nosso cotidiano: o sal comum,
NaCl (cloreto de sódio), está presente em nossa alimentação, na conservação de
alimentos (carne-seca, bacalhau e outros) etc; o bicarbonato de sódio, NaHCO3,
é usado como antiácido e também no preparo de bolos e biscoitos; o sulfato de
sódio, Na2SO4 (sal de Glauber), e o sulfato de magnésio,
MgSO4 (sal amargo), são usados como purgante; o gesso usado em
ortopedia ou em construção é o sulfato de cálcio hidratado, 2 CaSO4.H2O; e assim por diante.
Os sais também são muito usados nas indústrias químicas. O sal
comum (NaCl) é muito usado na fabricação da soda cáustica (NaOH), do gás
hidrogênio (H2) e do gás cloro (Cl2). Outro exemplo
importante é o do calcário (CaCO3) usado na fabricação da cal (CaO),
do vidro, do cimento, como fundente em indústrias metalúrgicas etc.
Um sal normal é formado por um cátion B, proveniente da base, e um ânion A, proveniente do ácido, segundo o esquema:
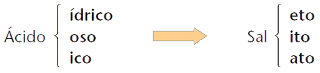
Nomenclatura dos sais normais
O nome de um sal normal deriva do ácido e da base que lhe dão origem. Assim, para obter o nome de um sal, basta alterar a terminação do nome do ácido correspondente, de acordo com o seguinte código:
Sais importantes
a) Cloreto de sódio — NaCl
É obtido da água do mar (processo de salinas) ou de minas
subterrâneas (sal-gema). É usado diretamente na alimentação ou na conservação
de carnes e de pescados.
Na alimentação, é importante que o sal contenha pequenas
quantidades de compostos do iodo (NaI, KI, NaIO3 etc.); caso
contrário, a pessoa poderá sofrer dilatação da glândula tireóide, uma doença
conhecida como bócio ou papo. Uma solução aquosa com 0,92% de NaCl é chamada de
soro fisiológico e é usada em medicina.
b) Carbonato de sódio — Na2CO3
É também conhecido como soda ou barrilha. Sua principal aplicação
é a fabricação do vidro, de acordo com a equação:
c) Hipoclorito de sódio —
NaOCl
É umalvejante usado no branqueamento de roupas (água de lavadeira
ou água sanitária).
É também vendido como “cloro” e usado no tratamento de piscinas.
Sendo agente anti-séptico, é usado na
limpeza de casas, hospitais etc. Em pequenas quantidades pode ser adicionado à
água para lavagem de vegetais.
Lembrete: Trata-se, apenas, de um resumo para alunos do 9º ano do fundamental, para alunos do ensino médio existem muitos outros detalhes a serem considerados e de fundamental importância.





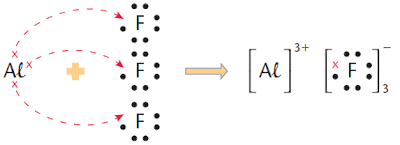


















2 comentários:
Eu estou estudando muitas coisa sobre química através de seu site obrigado.
Parabéns seu site e nota 10!!
Parabéns ..... Me ajudou bastante mais isso é mtoo difícil ... mas msmo assim obgdo ... ;)
Postar um comentário